Il Premio Nobel per la Chimica a David Baker, Demis Hassabis e John M. Jumper
Hanno innovato la progettazione e la previsione delle funzioni delle proteine con sistemi di intelligenza artificiale, con grandi ricadute in medicina, nella scienza dei materiali e non solo

Il Premio Nobel per la Chimica 2024 è stato assegnato a David Baker «per la progettazione computazionale delle proteine» e a Demis Hassabis e John M. Jumper «per i sistemi di predizione delle proteine».
Baker è riuscito in un’impresa che fino a qualche anno fa sembrava pressoché impossibile: creare nuovi tipi di proteine da zero. Hassabis e Jumper hanno sviluppato un modello di intelligenza artificiale che ha risolto un problema che durava da 50 anni: prevedere le strutture complesse delle proteine. I progressi raggiunti grazie ai loro studi offrono grandi opportunità per lo sviluppo di nuove molecole, specialmente in ambito farmaceutico.
Le proteine sono centrali nella nostra esistenza e in quella degli altri esseri viventi: regolano il metabolismo, la risposta agli stimoli e sono essenziali per il trasporto delle molecole, solo per fare qualche esempio. I vari tipi di proteine hanno proprie caratteristiche determinate dalle catene di amminoacidi che le costituiscono e dalla forma che assumono, ripiegandosi su loro stesse. La forma è essenziale nel determinare la funzione, e per questo in biologia molecolare si dice spesso che “la struttura è la funzione” di una proteina.
La maggior parte delle proteine ha dimensioni comprese tra 1 e 100 nanometri (un nanometro equivale a un miliardesimo di metro) ed è quindi molto difficile studiarne la struttura. Negli ultimi decenni, buona parte degli esperimenti di biologia molecolare ha riguardato proprio le tecniche e i metodi da impiegare per provare a comprendere come specifiche proteine si ripieghino su loro stesse.
Grazie a una tecnica che sfrutta i raggi X (cristallografia a raggi X), a partire dagli anni Cinquanta divenne possibile determinare la struttura di alcune proteine. Le tecniche si sarebbero poi affinate ulteriormente nell’ultimo decennio grazie alla microscopia crioelettronica, che prevede l’osservazione dei campioni a temperature estremamente basse, offrendo migliori risultati e riducendo il rischio di modificare le molecole nella fase di preparazione del materiale da osservare.
Comprendere l’effettiva forma tridimensionale della proteina dalle osservazioni al microscopio nell’infinitamente piccolo, dove i campioni appaiono come se fossero bidimensionali, non era semplice e richiedeva spesso anni di lavoro, senza garanzie di arrivare a qualcosa di concreto. Per questo motivo, già a partire dagli anni Ottanta, alcuni ricercatori si chiesero se non fosse possibile seguire un approccio diverso: partire dalle catene di amminoacidi e scoprire come queste determinino la struttura tridimensionale delle proteine di cui fanno parte. Non era una cosa da poco e i ricercatori pensarono di sfruttare una risorsa che 40 anni fa iniziava a dimostrare di avere crescenti capacità di calcolo: i computer.
I primi modelli informatici si rivelarono però poco affidabili, soprattutto dal punto di vista della riproducibilità dei risultati, uno dei pilastri del metodo scientifico. Un modello che si era rivelato adeguato nel determinare la struttura di una proteina, falliva miseramente se applicato da altri ricercatori per i loro studi su proteine di altro tipo. Per questo a metà degli anni Novanta fu fondato il Critical Assessment of protein Structure Prediction (CASP), un’iniziativa per mettere in competizione ogni due anni i centri di ricerca stimolandoli a produrre nuove soluzioni al computer per la previsione delle proteine.
Nonostante le buone intenzioni, per molti anni i risultati non furono comunque soddisfacenti. Le cose cambiarono solo verso la fine degli anni Dieci, quando il settore fu rivoluzionato dai lavori di Demis Hassabis. Appassionato del gioco degli scacchi fino dall’infanzia, Hassabis aveva cofondanto nel 2010 la società DeepMind con l’obiettivo di realizzare sistemi di intelligenza artificiale da applicare ad alcuni dei più diffusi giochi da tavolo. In pochi anni la start-up ottenne risultati notevoli tanto da essere acquisita da Google nel 2014 desiderosa di estendere e potenziare la propria presenza nel settore delle AI.
DeepMind divenne molto famosa quando uno dei propri sistemi riuscì a battere il campione mondiale di GO, un gioco da tavola con un numero enorme di possibili combinazioni, ma Hassabis aveva ambizioni ancora più grandi e l’obiettivo di partecipare al CASP. Nel 2018 il suo sistema per determinare la struttura delle proteine chiamato AlphaFold vinse la competizione raggiungendo un’accuratezza del 60 per cento, ben oltre il 40 per cento raggiunto nelle competizioni precedenti. Era un risultato sorprendente, ma ancora distante dalla completa capacità di previsione, ultimo obiettivo del CASP.
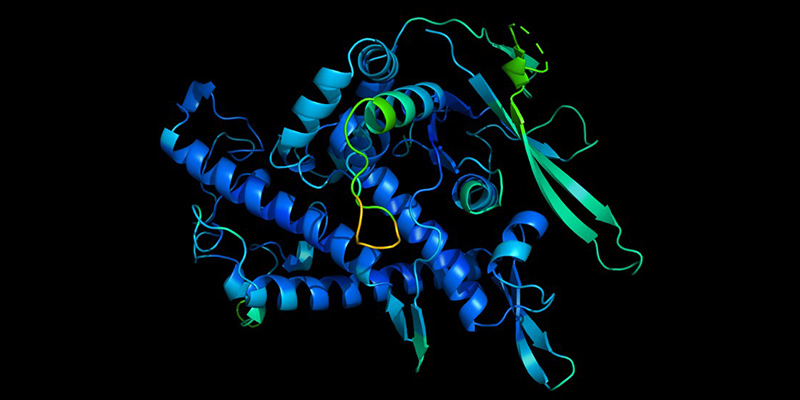
Previsione della struttura di una proteina effettuata da AlphaFold (DeepMind)
Nel gruppo di lavoro di AlphaFold c’era John Jumper, un ricercatore che aveva studiato fisica e matematica e che si era appassionato alle simulazioni al computer intorno alle proteine. Jumper aveva sviluppato sistemi per rendere più efficienti i programmi che effettuavano i calcoli nel periodo in cui lavorava al proprio dottorato in fisica teorica, perché i computer dell’università in cui studiava non erano molto potenti. Quando si unì al gruppo di lavoro di AlphaFold propose di utilizzare alcuni di quei sistemi e lavorò insieme a Hassabis a una nuova versione del sistema di AI, chiamato AlphaFold2. Il sistema poteva inoltre contare sugli ultimi sviluppi nelle reti neurali artificiali, soluzioni che imitano il funzionamento del nostro cervello.
Nel 2020 AlphaFold2 era pronto per competere al CASP e portò a risultati eccezionali, mai visti prima e con una accuratezza comparabile ai più lunghi lavori di studio e osservazione ottenuti con la cristallografia. Il settore dell’analisi delle proteine era cambiato grazie a un nuovo strumento per comprendere le loro caratteristiche e funzionalità in base alla loro struttura.
AlphaFold2 permise in poco tempo di calcolare la struttura di tutti i tipi di proteine che costituiscono il nostro organismo. La grande potenza di calcolo permise in seguito di spingersi ancora oltre e di creare una sorta di catalogo in cui è prevista la struttura di praticamente tutti i 200 milioni di proteine finora scoperte nello studio degli organismi viventi della Terra. DeepMind ha inoltre reso libero e accessibile il codice di AlphaFold2 e il modello è stato impiegato per una grandissima varietà di ricerche in praticamente ogni paese del mondo. Se un tempo occorrevano spesso anni per ottenere la struttura di una proteina, ora quel lavoro può essere svolto in pochi minuti con un grado molto alto di accuratezza, che può essere valutato e corretto.
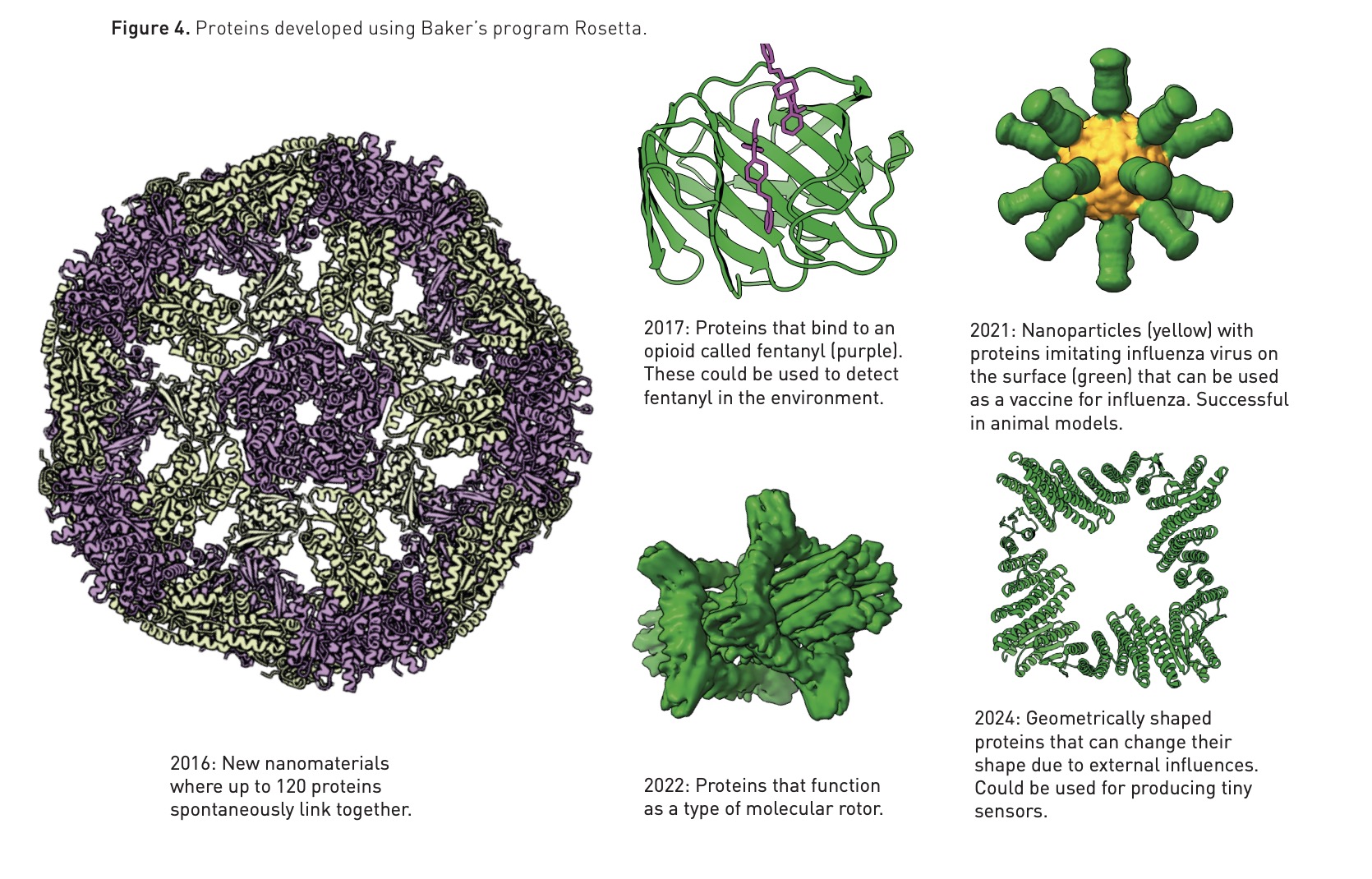
Quando il biochimico David Baker venne a conoscenza dei risultati di AlphaFold2 pensò di trarre ispirazione per migliorare un programma che aveva realizzato quasi 30 anni prima: Rosetta. Baker insieme al suo gruppo di ricerca aveva inizialmente pensato a un software per fare previsioni sulle strutture delle proteine, ma in seguito si era chiesto se non potesse essere utilizzato al contrario per progettare nuovi tipi di proteine mai osservate prima e con specifiche funzioni.
(Nobel Prize)
Alla fine degli anni Novanta, Baker iniziava a essere un’autorità nel campo della progettazione delle proteine e divenne molto famoso nel 2003, quando pubblicò uno studio che illustrava i risultati raggiunti nella creazione di Top7, una proteina che non esisteva in natura. Negli anni seguenti, Baker progettò e realizzò diverse altre proteine che potrebbero essere impiegate in numerosi ambiti, dalla produzione di vaccini di nuova generazione a sistemi per rilevare la presenza di particolari sostanze in un ambiente, o ancora per produrre sensori o motori per il trasporto di molecole nell’organismo.
I risultati ottenuti dai tre premiati di quest’anno con il Nobel per la Chimica stanno già avendo e avranno un forte impatto nella ricerca e nello sviluppo di nuovi materiali, farmaci e altre applicazioni. Hanno inoltre permesso di comprendere meglio come funziona la vita e come si sviluppano alcune malattie, offrendo nuove possibilità di ricerca per curarle. Quei sistemi di analisi, previsione e progettazione si sono aggiunti ad altri metodi utilizzati già da tempo nel settore, con risultati alterni, e che non sempre hanno avuto la stessa visibilità di DeepMind, che ha potuto contare sulle enormi risorse economiche e di comunicazione di Google.
David Baker è nato nel 1962 a Seattle, negli Stati Uniti, ed è docente presso l’Università di Washington.
Demis Hassabis è nato nel 1976 a Londra, nel Regno Unito, ed è CEO di Google DeepMind.
John M. Jumper è nato nel 1985 a Little Rock, negli Stati Uniti, ed è ricercatore scientifico di Google DeepMind.



