Fatichiamo ancora a spiegarci il vetro
È un solido con alcune caratteristiche dei liquidi, un bel mistero per i fisici che nel tempo hanno formulato tante teorie poco convincenti

Se non esistesse il vetro probabilmente non stareste leggendo questo articolo, non solo perché costituisce lo schermo del vostro dispositivo, ma anche perché Internet funziona in buona parte grazie alle reti in fibra ottica, sottili filamenti di vetro attraverso i quali passano i dati sotto forma di impulsi di luce. È del resto sufficiente guardarsi intorno per notare quanto il vetro sia presente nelle nostre esistenze, tanto da dare per scontata la sua esistenza. La maggior parte delle persone non vi dedica molti pensieri, a parte quando deve riciclare qualche bottiglia o rompe un bicchiere, con alcune eccezioni: i vetrai, sicuramente, ma anche i fisici. Per questi ultimi il vetro è un mistero, o per meglio dire un problema ancora da risolvere.
Per chi il vetro lo fa, la produzione non ha niente di così misterioso, anche perché è un processo che abbiamo affinato in millenni. Il più comune e diffuso è il vetro alla calce-soda, realizzato partendo dalla silice derivata dalla sabbia e da ossidi di calcio e sodio. Riducendo la quantità di questi due ultimi ingredienti e aggiungendo il triossido di boro si ottiene il vetro borosilicato, come per esempio il “pirex”, con una maggiore resistenza ai forti sbalzi di temperatura e per questo utilizzato per cucinare oppure nei laboratori. La miscela di ingredienti viene portata ad alta temperatura in una fornace, che supera i 1800 °C, ottenendo del materiale fuso incandescente e malleabile che viene poi lavorato per dargli la forma desiderata, in alcuni casi attraverso la tecnica della soffiatura. Il prodotto ottenuto viene poi fatto raffreddare, fino a quando diventa solido, almeno all’apparenza.
A scuola infatti impariamo che lo stato di aggregazione delle molecole, o più semplicemente lo “stato della materia”, può essere sostanzialmente di tre tipi: solido, liquido e gassoso (cui si aggiunge il plasma, che è costituito da gas ionizzati). In linea di massima, un materiale può passare attraverso i tre stati e comportarsi molto diversamente, proprio a seconda dello stato in cui si trova. A livello microscopico, la differenza è dovuta in sostanza al modo in cui si muovono gli atomi o le molecole: all’aumentare della temperatura, per esempio, diventano più energetiche e tendono quindi a muoversi di più di quanto facciano a temperature estremamente basse. Ed è questo movimento a determinare, insieme ad altri fattori, lo stato di aggregazione.
Una sostanza può evaporare – passando dallo stato liquido a quello gassoso – come fa per esempio l’acqua riscaldata in una teiera. Oppure una sostanza può passare dallo stato solido a quello gassoso senza passare per quello liquido, come fa un blocco di ghiaccio secco a temperatura ambiente (altro non è che anidride carbonica in entrambi i casi, in stati diversi, appunto).
C’è però una fase in cui una sostanza sembra avere allo stesso tempo le caratteristiche di un solido e di un liquido. È la “fase vetrosa” nella quale un materiale ha un comportamento paragonabile a quello di un solido, ma la sua struttura è disordinata come quella di un liquido. La natura della transizione vetrosa che regola questo fenomeno è studiata da tempo, ma non ha a oggi trovato risposte soddisfacenti. Più in generale, non è stata ancora trovata una spiegazione completa ai processi che portano il vetro ad avere le proprietà che conosciamo, e che in definitiva fanno sì che lo trattiamo come un solido pur sapendo che è anche qualcos’altro.
In molti casi, il modificarsi della temperatura è il principale responsabile dei cambiamenti di stato. In un sistema, man mano che questa diminuisce, gli atomi o le molecole si muovono sempre meno fino a quando non riescono più a spostarsi ma solo a “vibrare”, rimanendo al medesimo posto. Questo rallentamento del loro movimento può avere effetti diversi.
Il primo è quello in cui gli atomi si dispongono in modo ordinato, mantenendo una certa distanza gli uni dagli altri e una disposizione geometrica sempre uguale nello spazio. In questo caso formano un “reticolo cristallino” che a seconda di come è fatto può influenzare fortemente le proprietà del materiale. Il modo in cui gli atomi di carbonio si dispongono in base alla variazione della temperatura (e della pressione), per esempio, può dare origine a solidi cristallini con marcate differenze nella loro durezza, producendo della grafite oppure del diamante.
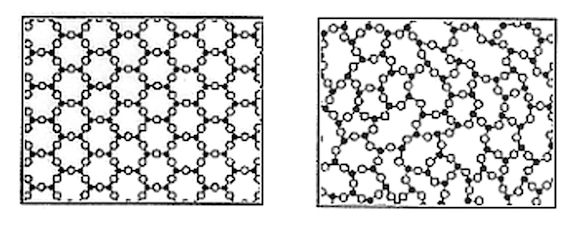
Esempio di un reticolo cristallino, a sinistra, e di una struttura amorfa (Cornig)
Il secondo è quello in cui il cambiamento di stato avviene in modo più disordinato: gli atomi non si organizzano in strutture ordinate e riducono drasticamente i loro movimenti mantenendo una distribuzione paragonabile a quella che avevano allo stato liquido. Una sostanza in queste condizioni viene definita amorfa, cioè senza forma definita, contrariamente a quella ordinata dei solidi cristallini. Il vetro è quindi un solido amorfo e lo possiamo definire, con una certa approssimazione, come uno stato intermedio tra solido e liquido.
Buona parte dei solidi è di natura cristallina, motivo per cui vista l’eccezione che costituiscono a volte ci si riferisce ai solidi amorfi parlando di “stato vetroso”, ma non c’è solamente il vetro propriamente detto: qualsiasi solido che presenti le molecole in strutture non cristalline, come vari tipi di plastica o di materiali ceramici, è tecnicamente un vetro.
Un liquido ha la caratteristica di spostarsi con relativa facilità e di adattarsi a ciò che lo contiene, come fa per esempio dell’acqua all’interno di una tubatura. Questa capacità è legata alla viscosità: più gli atomi hanno difficoltà a muoversi, più possiamo dire che un liquido è viscoso. In condizioni di temperatura e pressione standard, l’acqua ha una viscosità di 1 mPa∙s (cioè di un millipascal-secondo), quindi molto bassa. Il miele, come sa bene chiunque provi a spalmarlo su una fetta biscottata senza romperla, ha una viscosità pari a diecimila volte quella dell’acqua. A differenza di quest’ultima, a parità di condizioni, gli atomi nel miele si possono muovere meno facilmente tra loro.
Nel caso dei solidi amorfi l’ordine di grandezza è molto maggiore, circa un milione di miliardi (1015) rispetto alla viscosità dell’acqua. Ciò che è sorprendente, o per lo meno ancora inspiegabile fino in fondo, è come sia possibile che la struttura rimanga pressoché la stessa nel passaggio da liquido a solido amorfo, mentre la viscosità aumenti così tanto. Per quanto ne sappiamo, una sostanza con gli atomi disposti in strutture paragonabili dovrebbe comportarsi allo stesso modo, eppure non lo fa.
L’argomento è dibattuto da tempo tra i fisici e chi si occupa di ingegneria dei materiali, e ha portato anche a qualche accesa diatriba tra chi sostiene di avere risolto la questione e i loro detrattori. Nell’ultima ventina di anni qualche progresso è stato raggiunto grazie ad alcune simulazioni al computer, che permettono di ricreare vari scenari sulla transizione vetrosa.
È per esempio emerso che man mano che il vetro fuso si solidifica le molecole che lo costituiscono non rallentano uniformemente. In alcune zone il processo è molto rapido e le porta a comportarsi come farebbero in un solido, in altre è invece più lento e continuano a muoversi come farebbero in un liquido. Anche in questo caso, dal punto di vista strutturale, le varie aree hanno le medesime caratteristiche. La particolarità del fenomeno ha fatto sì, come ha detto qualcuno una volta, che ci siano «più teorie sulla transizione vetrosa di quanti teorici che le propongono».
Alla lunga lista delle teorie si è da poco aggiunto uno studio pubblicato sulla rivista scientifica PNAS e realizzato da un gruppo di ricerca dell’Università della California, Berkeley. Basandosi su alcune simulazioni al computer ed esperimenti svolti in precedenza, è stata elaborata una teoria secondo la quale nel vetro le molecole si riconfigurano di continuo, con movimenti molto localizzati. Il gruppo di ricerca l’ha sperimentata in una condizione bidimensionale e partendo dai solidi cristallini, ma ritengono di poterla applicare anche a un modello tridimensionale rilevando quella che potrebbe essere una fase ancora sconosciuta, coinvolta nella formazione dei solidi amorfi.
Un altro studio pubblicato sempre quest’anno e realizzato in Germania e Italia ha preso in considerazione i dati sull’espansione termica e la transizione vetrosa raccolti su oltre 200 materiali nel corso degli ultimi cento anni. L’analisi ha permesso di identificare altre variabili, oltre al movimento degli atomi, da valutare quando si studiano i solidi amorfi. In particolare, hanno rilevato come a livello microscopico gli atomi o le molecole di questi materiali non si muovano in modo indipendente.
Ogni anno si aggiungono nuove ricerche sul tema che confermano gli studi precedenti o propongono teorie alternative. Scoprire qualcosa di più sul fenomeno potrebbe rivelarsi molto utile non solo per capire un pezzetto in più su come funziona il mondo, e probabilmente vincere un premio Nobel, ma anche per sfruttare le nuove conoscenze per sviluppare tecnologie innovative. In ambito medico, per esempio, alcuni farmaci potrebbero essere prodotti come solidi amorfi invece che in una forma cristallina, in modo da renderli più semplici da somministrare e da assimilare nel momento in cui entrano in contatto con il nostro organismo.

(Getty Images)
In attesa di nuovi sviluppi, tra tante incertezze c’è comunque qualcosa di certo su una delle cose che si sentono dire spesso sul vetro. Secondo una convinzione piuttosto diffusa, i vetri delle cattedrali sarebbero più spessi alla base perché nel corso dei secoli la forza di gravità fa sì che il vetro – non essendo del tutto solido – fluisca verso il basso complice l’effetto del proprio stesso peso. In realtà la viscosità del vetro è tale da rendere impossibile una circostanza simile in tempi prettamente umani.
Uno studio ha calcolato che a temperatura ambiente sarebbero necessari centomila miliardi di miliardi di anni perché ciò avvenga, tantini considerato che l’Universo ha un’età stimata di 13,8 miliardi di anni. I vetri delle cattedrali europee più antiche hanno talvolta la parte inferiore più spessa semplicemente per il modo in cui venivano realizzati, con tecniche che non consentivano di avere uno spessore uniforme paragonabile a quello dei vetri che usiamo alle finestre dei giorni nostri.



