No, i vaccini contro il coronavirus non sono “sperimentali”
Quella fase è finita da un pezzo, altrimenti non sarebbero stati autorizzati per l'uso su centinaia di milioni di persone

I contrari alla vaccinazione contro il coronavirus giustificano spesso la loro posizione sostenendo che gli attuali vaccini siano “sperimentali”, e che di conseguenza non siano sicuri o affidabili a sufficienza per essere utilizzati. È una posizione condivisa da diverse persone, non necessariamente solo nei gruppi dei cosiddetti “no vax”, ma è basata su un assunto completamente privo di fondamento. I vaccini contro il coronavirus autorizzati in Italia, come nel resto dell’Unione Europea e negli Stati Uniti, non sono sperimentali e la loro sicurezza ed efficacia è garantita dalle costanti verifiche delle autorità di controllo sulle ormai centinaia di milioni di dosi somministrate.
Un vaccino può essere definito “sperimentale” nel momento in cui è sviluppato e testato nelle sue fasi iniziali dai ricercatori. Viene prima di tutto sottoposto a numerosi test e analisi di laboratorio, per verificarne qualità e caratteristiche.
Superati questi primi controlli, i ricercatori avviano i test non clinici, quindi da eseguire in laboratorio in vitro su campioni di cellule e su cavie. È un primo passaggio molto delicato e utile per assicurarsi non solo che il vaccino faccia ciò per cui è stato sviluppato, ma anche che sia sicuro e non comporti particolari effetti avversi.
Raggiunti gli standard di sicurezza, si procede con i test clinici, cioè svolti su esseri umani. I test sono solitamente suddivisi in tre fasi: nella prima si valuta su un numero molto ridotto di volontari la sicurezza del vaccino; nella seconda si fanno le medesime valutazioni, ma su un numero più alto di individui e raccogliendo già alcune informazioni sull’efficacia del vaccino; infine nella terza fase si effettua una sperimentazione su decine di migliaia di volontari per appurare che il vaccino sia efficace, oltre che sicuro.
Le informazioni raccolte in queste tre fasi, più quelle pre-cliniche, vengono poi comunicate alle autorità di controllo, che effettuano le loro analisi e valutazioni e danno infine l’approvazione necessaria per impiegare il vaccino tra la popolazione.
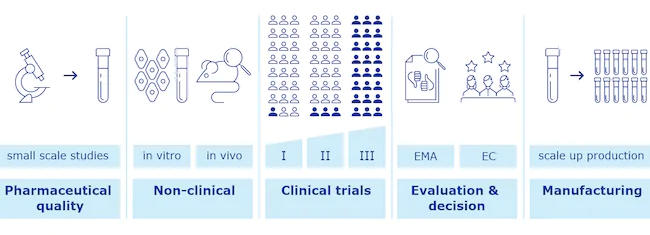
(EMA)
In generale, questo processo di verifica avviene per tutti i farmaci e richiede molto tempo per essere eseguito. Nel caso dei vaccini contro il coronavirus, le autorità di controllo hanno proceduto molto più velocemente sia coordinandosi meglio con chi stava svolgendo i test clinici, richiedendo i dati man mano che diventavano disponibili, sia dedicando molte più risorse e personale per farlo.
La Food and Drug Administration (FDA) negli Stati Uniti e l’Agenzia europea per i medicinali (EMA) hanno potuto in questo modo autorizzare i primi vaccini già alla fine del 2020, rendendo possibile il loro impiego in tempi rapidi per vaccinare milioni di individui.
Negli Stati Uniti l’FDA ha concesso un’autorizzazione di emergenza, mentre in Europa l’EMA ha proceduto con una serie di autorizzazioni all’immissione in commercio condizionata (CMA) dei vaccini, che sono state poi recepite dalle autorità di controllo sui farmaci dei singoli stati membri (nel caso dell’Italia dall’AIFA).
Un’autorizzazione di emergenza e una CMA portano nei fatti a un risultato simile, cioè alla possibilità di utilizzare da subito i vaccini, ma mantengono comunque qualche differenza.
Nel caso dell’autorizzazione di emergenza negli Stati Uniti, l’impiego del vaccino è consentito, anche se questo non è stato completamente approvato perché l’FDA chiede di avere diversi mesi di dati sui volontari che avevano partecipato ai test clinici. In mancanza della piena approvazione, il vaccino può quindi essere impiegato con qualche limitazione e rende più difficile l’adozione di provvedimenti che lo rendano obbligatorio. Il vaccino di Pfizer-BioNTech era stato per esempio autorizzato negli Stati Uniti a metà dicembre 2020, mentre l’approvazione è arrivata il 23 agosto scorso. In quell’arco di tempo il vaccino era stato impiegato per centinaia di milioni di vaccinazioni e sottoposto ai controlli di utilizzo (farmacovigilanza) e non era “sperimentale” da un pezzo.
La CMA per il vaccino di Pfizer-BioNTech era stata fornita dall’EMA il 21 dicembre 2020, e una successiva decisione della Commissione europea lo aveva reso disponibile per l’utilizzo nell’Unione nei giorni seguenti. L’autorizzazione era, ed è ancora, di tipo condizionale perché l’EMA chiede che siano raccolti dati per almeno un anno sull’andamento del vaccino, in modo da avere elementi ancora più solidi per rendere definitiva l’autorizzazione. Una CMA può comunque essere considerata equivalente a un’approvazione della FDA nei risultati, rendendo quindi il vaccino pienamente utilizzabile e con possibilità di essere reso obbligatorio, a discrezione dei governi.
Processi di autorizzazione analoghi hanno finora interessato i vaccini di AstraZeneca, Moderna e Johnson & Johnson nell’Unione Europea.
Tutti i vaccini a oggi disponibili contro il coronavirus sono quindi autorizzati o approvati a seconda dei casi, ma comunque certamente non sperimentali. Solo nell’Unione Europa ne sono state somministrate più di 550 milioni di dosi, sotto il controllo della farmacovigilanza e senza rilevare particolari problemi. Gli eventuali rischi dovuti alla vaccinazione sono estremamente bassi, e di molto inferiori rispetto a quelli che si corrono nel caso di un’infezione da coronavirus.



