A che punto è il vaccino di Johnson & Johnson
Con una sola dose e conservazione più semplice, è tra le soluzioni più promettenti contro il coronavirus: sta terminando i test, ma la produzione è in ritardo
Questa settimana la multinazionale statunitense Johnson & Johnson (J&J) ha pubblicato i risultati dei primi test clinici sul proprio vaccino contro il coronavirus, confermando i dati promettenti anticipati lo scorso settembre. Il vaccino di J&J potrebbe rivelarsi fondamentale per contenere la pandemia, perché si conserva più facilmente rispetto a quelli autorizzati finora, che richiedono potenti congelatori, e potrebbe bastarne una sola dose per individuo, ma l’azienda negli ultimi mesi ha accumulato qualche ritardo nella produzione dei primi milioni di dosi.
Come avevano fatto Pfizer-BioNTech e Moderna, anche J&J si era messa a produrre il proprio vaccino prima di ricevere l’autorizzazione dalle autorità di controllo negli Stati Uniti e in Europa, in modo da avere scorte a sufficienza per avviare le consegne appena ricevuti i permessi. I suoi dirigenti si erano impegnati a fornire 12 milioni di dosi entro la fine di febbraio negli Stati Uniti, arrivando poi a 100 milioni di dosi entro la fine di giugno. La produzione è però in ritardo di circa due mesi e difficilmente potrà essere riportata in pari prima di aprile.
Per gli Stati Uniti potrebbe essere un serio problema perché avevano fatto grande affidamento sul vaccino di J&J per contenere la pandemia. Il governo statunitense aveva stretto un accordo da 1 miliardo di dollari lo scorso agosto, proprio con l’obiettivo di avere il prima possibile un ulteriore vaccino più pratico ed economico rispetto a quelli di Pfizer-BioNTech e Moderna.
Il vaccino di J&J è atteso anche in Europa, dove la Commissione Europea nei mesi scorsi aveva contrattato la fornitura di almeno 200 milioni di dosi, con un’opzione per acquistarne altri 200 milioni. Il ritardo potrebbe complicare la campagna vaccinale in alcuni paesi europei, che hanno già dovuto fare i conti con i problemi del vaccino di AstraZeneca-Oxford, con sensibile ritardo a causa di alcuni errori nella gestione dei test clinici.
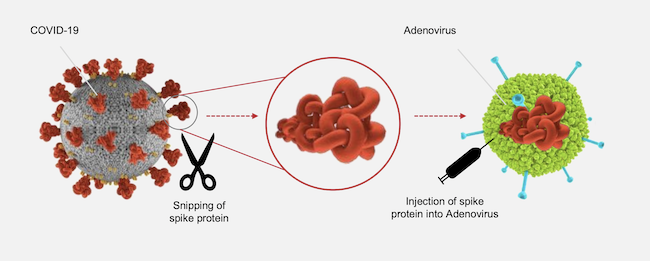
A differenza di Pfizer-BioNTech e Moderna, che hanno realizzato vaccini basati sull’RNA messaggero, J&J ha seguito un approccio più tradizionale. Il suo vaccino è basato su un adenovirus che non causa particolari problemi di salute, nel quale è stato inserito un gene contenente le istruzioni per produrre una proteina del coronavirus. Quando si riceve una dose, gli adenovirus inducono alcuni tipi di cellule a produrre copie della proteina, che viene poi riconosciuta come una minaccia dal sistema immunitario. In questo modo, il nostro organismo impara a sviluppare una difesa contro la proteina del coronavirus, senza dover entrare in contatto con il coronavirus vero e proprio, evitando i rischi del caso.
(Johnson & Johnson)
Questa soluzione non è una novità. Era già stata sperimentata in passato con altri tipi di vaccini, compresi quelli per contrastare la malattia Ebola. Un vaccino di questo tipo è solitamente ben tollerato dal nostro organismo e non comporta particolari reazioni avverse.
Nei test di laboratorio su primati non umani, i ricercatori avevano rilevato che una singola dose offriva una protezione sufficiente. Nelle fasi successive di sperimentazione, su esseri umani, avevano poi scoperto che modulando la concentrazione del vaccino si poteva ottenere una formula per indurre una forte reazione immunitaria con una sola dose.
I risultati pubblicati questa settimana, e riferiti alle prime due fasi (su tre) dei test clinici, confermano queste circostanze. A giorni di distanza dalla vaccinazione, i ricercatori hanno sottoposto 71 volontari a un esame del sangue, rilevando una concentrazione ancora alta di anticorpi sviluppati dall’organismo per contrastare il coronavirus. In alcuni volontari, la concentrazione era in sensibile aumento, indicando un’attività ancora in corso del sistema immunitario indotta dal vaccino.
Sulla base di questi risultati, la scorsa estate J&J aveva deciso di avviare l’ultima fase di test clinici scommettendo sulla singola dose, e organizzando di conseguenza la sperimentazione in questo senso. Sperimentare la somministrazione di due dosi sarebbe stato probabilmente più semplice e avrebbe offerto più probabilità di successo, ma l’azienda ha ritenuto che i risultati delle prime due fasi fossero promettenti a sufficienza da rischiare.
Se, come sembra, la fase 3 si concluderà con risultati positivi sull’efficacia, J&J avrà dimostrato che il proprio vaccino può essere somministrato con una sola dose, diventando molto più competitivo rispetto alle soluzioni di Pfizer-BioNTech e Moderna. Somministrare una sola dose implica procedere molto più velocemente con le campagne vaccinali di massa, e riduce la possibilità che molte persone non completino la vaccinazione con la seconda iniezione. Il vaccino di J&J dovrebbe essere inoltre più economico dei due concorrenti finora autorizzati.
Mentre procedeva con i test clinici, J&J aveva avviato alcune prove di produzione in uno stabilimento nei Paesi Bassi (il vaccino è sviluppato in collaborazione con l’europea Janssen Pharmaceutica, di proprietà di J&J), verificando la possibilità di produrre grandi quantità del vaccino rapidamente e in modo affidabile. L’azienda si era anche messa in contatto con altre società in giro per il mondo per condividere progetti e programmi di produzione, in modo da poter coprire più mercati con il proprio vaccino una volta autorizzato.
Utilizzando colture cellulari che a loro volta producono gli adenovirus necessari per il vaccino, il sistema di J&J è piuttosto delicato e comporta alcuni passaggi in più rispetto a quello sviluppato da Pfizer-BioNTech e da Moderna. Anche per questo motivo si è reso necessario più tempo del previsto per affinare le tecniche, con ritardi che si sono via via accumulati e che l’azienda confida di riassorbire entro la metà di quest’anno, quando la produzione sarà a pieno regime.
Prima di consegnare le dosi, J&J dovrà però terminare i test clinici di fase 3 avviati nell’estate del 2020 e temporaneamente interrotti in autunno. La sperimentazione è in corso negli Stati Uniti e in diversi altri paesi compresi Argentina, Cile, Ucraina, Sudafrica e Filippine. L’azienda confida di avere tutti i dati necessari sull’ultima fase di sperimentazione entro la fine di gennaio e i primi giorni di febbraio. La loro analisi spetterà a un gruppo consultivo indipendente e in seguito il vaccino dovrà ricevere l’autorizzazione di emergenza. La valutazione di parte dei dati è in realtà già in corso da parte delle autorità di controllo, che hanno ridotto il più possibile i tempi burocratici considerata l’emergenza sanitaria causata dalla pandemia.
Il governo degli Stati Uniti ha comunque confermato che J&J non riuscirà a produrre entro fine febbraio i 12 milioni di dosi promesse. A oggi non è chiaro se riuscirà a produrne più di 10 milioni, ma è previsto che le cose migliorino con le forniture di marzo e di aprile. Le stime più pessimistiche parlano di massimo 4 milioni di dosi consegnate entro la fine di febbraio, e solo negli Stati Uniti. L’azienda per ora dice di essere ottimista sulla possibilità di intensificare la produzione, ma non ha fornito dati precisi.
Il ritardo ha portato a qualche critica nei confronti di “Operation Warp Speed”, l’iniziativa avviata dall’amministrazione Trump per accelerare lo sviluppo dei vaccini, con finanziamenti pubblici anticipati a diversi produttori in modo che avviassero la produzione ancora prima di ricevere l’autorizzazione e avere da subito dosi a disposizione.



