La grande scommessa
Milioni di persone potrebbero ricevere presto vaccini contro il coronavirus basati su un sistema rivoluzionario e mai provato prima: funzionerà?
di Emanuele Menietti – @emenietti

Katalin Karikó pensò di avere avuto un’ottima idea, di quelle con il potenziale per rivoluzionare la medicina, ma si sentì dire “no” per l’ennesima volta dai suoi colleghi e da chi avrebbe potuto finanziare la sua ricerca. Erano i primi anni Novanta, aveva quasi 40 anni e si era trasferita negli Stati Uniti dall’Ungheria, dove aveva studiato biochimica. Aveva dedicato buona parte dei propri studi a come sfruttare i metodi utilizzati dalle cellule per produrre migliaia di proteine con funzioni diverse tra loro, applicando lo stesso concetto al funzionamento dei farmaci. Mentre raccoglieva insuccessi per ottenere qualche finanziamento, non avrebbe immaginato che meno di 30 anni dopo la sua intuizione sarebbe diventata una delle armi più promettenti per fermare la più grave pandemia dell’ultimo secolo.
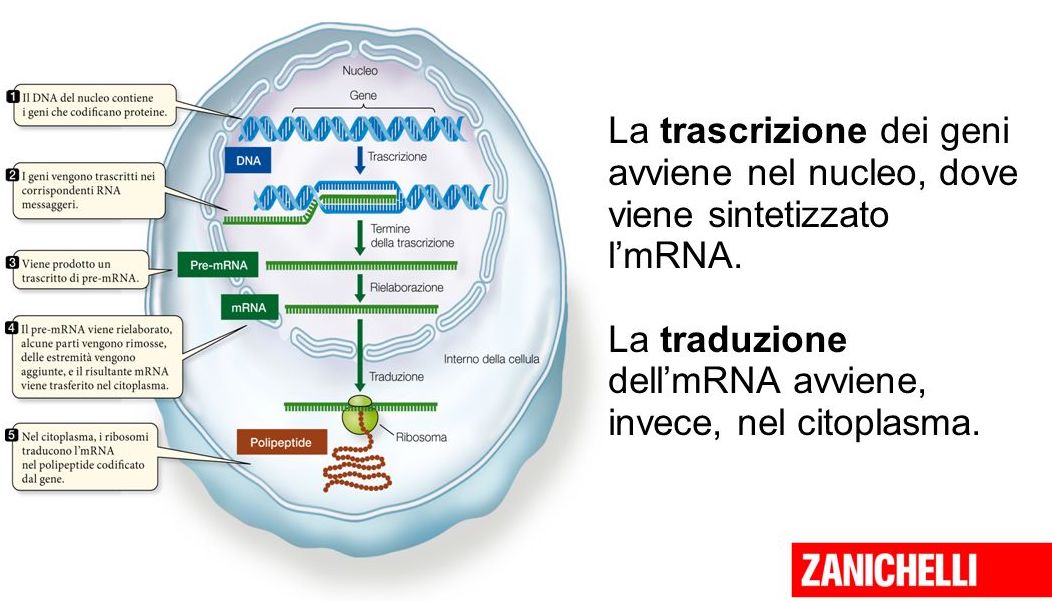
Se Pfizer-BioNTech e Moderna nelle ultime settimane hanno ottenuto risultati giudicati incoraggianti per i loro vaccini è anche merito di Karikó, e degli altri ricercatori che da anni si dedicano allo studio dell’RNA messaggero (mRNA), la molecola che si occupa di codificare e portare le istruzioni contenute nel DNA nelle cellule, per far produrre loro le proteine, alla base di tutti i meccanismi che ci fanno esistere.
I due vaccini sperimentali basati su questo sistema hanno mostrato livelli di efficacia superiori al 90 per cento nelle ultime fasi di sperimentazione, e potrebbero ricevere presto autorizzazioni di emergenza per essere distribuiti alla popolazione. Pfizer e Moderna hanno investito grandi risorse sul loro sviluppo, scommettendo sulla possibilità di ottenere enormi ricavi nel caso di un successo. A oggi nessun vaccino basato sull’mRNA è stato mai autorizzato per un impiego su larga scala e per questo gli esperti consigliano di mantenersi cauti: anche se ci sono buoni indizi, l’esito della scommessa è ancora da scoprire.
“No, no, no”
Siamo tra gli esseri viventi più complessi ad avere mai vissuto su questo pianeta, e probabilmente siamo anche l’unica specie a essere pienamente consapevole della propria complessità. I miliardi di cellule di ciascuno di noi sono programmati grazie al materiale genetico, che viene trascritto in continuazione per consentire alle cellule di replicarsi e di produrre le proteine che provvedono a buona parte del loro funzionamento.
Consapevole del ruolo centrale dell’mRNA in questo processo, negli anni Novanta Karikó iniziò a chiedersi se la molecola potesse essere utilizzata per contrastare alcune malattie. Era un proposito molto ambizioso, forse troppo per l’epoca, e stava costando alla ricercatrice numerosi rifiuti di finanziamento da parte di università, fondi pubblici e privati negli Stati Uniti.
L’idea di base di Karikó non era in realtà così esotica: visto che le cellule ricevono istruzioni dall’mRNA per produrre le proteine che ci mantengono vivi e in salute, perché non realizzare dell’mRNA sintetico per indurre le cellule a creare particolari proteine a proprio piacere? Potrebbero essere enzimi per ridurre gli effetti di una malattia, fattori di crescita per ripristinare attività nel sistema nervoso, o ancora anticorpi per renderci immuni da specifiche malattie.
Nel 1990 un gruppo di ricercatori dell’Università del Wisconsin era riuscito a ottenere un risultato simile su alcune cavie di laboratorio, ma Karikó voleva andare oltre con progetti di ricerca più articolati. C’era però un problema di fondo, che era emerso anche da altre ricerche: il nostro organismo ha diversi sistemi di controllo e di difesa per evitare che istruzioni che ritiene scorrette nell’mRNA, come quelle modificate artificialmente, possano raggiungere le cellule facendo potenzialmente danni. La difesa comporta la distruzione delle informazioni, ma può anche portare a una risposta immunitaria, con infiammazioni e rischi per la salute.
Karikó era convinta di poter superare il problema, ma non riusciva a convincere chi avrebbe poi dovuto sostenere e finanziare le sue ricerche: “Ci lavoravo ogni notte: borsa di studio, borsa di studio, borsa di studio. E ricevevo sempre la stessa risposta: no, no e no” ha raccontato di recente. Dopo sei anni trascorsi presso l’Università della Pennsylvania, nel 1995 Karikó perse diverse possibilità di carriera proprio perché non aveva le risorse per portare avanti le proprie ricerche. Inoltre, aveva dovuto fare i conti con un grave problema di salute e con le difficoltà per il ricongiungimento con suo marito, che faticava a ottenere un visto per raggiungerla negli Stati Uniti.
“Pensai di andarmene da qualche altra parte, di mettermi a fare altro. Pensai anche di non essere sufficientemente brava, di non essere intelligente a sufficienza. Mi misi a pensare: è tutto qui, devo solo fare esperimenti migliori”, ha spiegato a STAT, che ha dedicato un lungo articolo alla storia dell’mRNA. Negli anni seguenti, Karikó perfezionò i propri esperimenti anche grazie alla collaborazione di Drew Weissman, un immunologo dell’Università di Boston, trovando infine una soluzione per eludere i sistemi di controllo del nostro organismo.
Passare inosservati
I due ricercatori andarono all’origine dell’mRNA, ai nucleosidi, i quattro mattoncini che lo compongono a livello molecolare e a che a seconda di come sono combinati forniscono le istruzioni alle cellule. Si resero conto che nelle versioni sintetiche – quindi realizzate in laboratorio – dell’mRNA uno dei mattoncini finiva per indurre le difese da parte dell’organismo, impedendo la trasmissione del manuale di istruzioni alle cellule per produrre le proteine desiderate. Dopo numerosi esperimenti, Karikó e Weissman trovarono il modo di modificare lievemente il mattoncino che faceva da spia, in modo che l’mRNA sintetico riuscisse a passare inosservato e a essere trasportato nelle cellule.
A partire dal 2005 iniziarono a pubblicare le loro scoperte su diverse riviste scientifiche, ricevendo attenzione per lo più da altri ricercatori che avevano iniziato a lavorare sull’mRNA. Il sistema funzionava, ma non era ancora molto raffinato e in pochi riuscivano a comprenderne a fondo le potenzialità. Tra questi c’erano due scienziati, che avrebbero avuto un ruolo fondamentale nella nascita di BioNTech e Moderna, ora al centro dell’attenzione per i loro promettenti vaccini contro il coronavirus.
Dalle staminali a Moderna
Partendo dagli studi di Karikó e Weissman, nel 2007 Derrick Rossi della Scuola di Medicina di Harvard (Stati Uniti) si chiese se l’mRNA sintetico potesse costituire una buona soluzione per produrre cellule staminali embrionali, le cellule al centro dello sviluppo degli embrioni e che non sono ancora differenziate, quindi con la potenzialità di dare origine a qualsiasi tipo di cellula presente in un organismo.
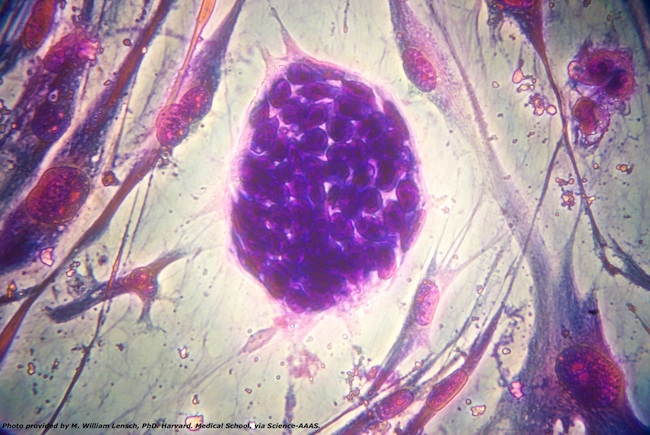
Cellule staminali embrionali (M. William Lensch, PhD. Harvard Medical School)
Le staminali sono una frontiera della medicina degli ultimi anni, ma quelle embrionali portano con sé diversi problemi etici, perché si ottengono dagli embrioni, il primo stadio del nostro sviluppo. Rossi pensò all’mRNA come a una fonte alternativa per produrre staminali, riprogrammando quelle che si trovano negli organismi adulti rendendole più versatili.
Quella che un paio di anni prima era sembrata un’ipotesi piuttosto fantascientifica divenne realtà tra il 2009 e il 2010. Rossi si mise in contatto con Robert Langer, un ricercatore del Massachusetts Institute of Technology (MIT), famoso nel campo biomedico per avere brevettato numerose soluzioni legate ai meccanismi per le terapie con farmaci mirati.
Rossi gli raccontò dei progressi sulle staminali raggiunti con l’mRNA e Langer, che aveva una maggiore sensibilità commerciale, intuì rapidamente che il sistema avesse grandi potenzialità nel campo della medicina, grazie alla possibilità di indurre le cellule a produrre praticamente qualsiasi tipo di proteina necessaria per determinate terapie.

Derrick Rossi (Tracy Rolling – Wikimedia)
Nel 2010, Rossi, Langer e Noubar Afeyan, del fondo di investimento Flagship Venture dedicato alle startup nel settore delle biotecnologie, fondarono la società Moderna. Il nome deriva dalle parole “modificato” (“modified” in inglese) e RNA, a indicare chiaramente il settore di specializzazione dell’azienda. In pochi anni, l’iniziativa avrebbe fruttato ai tre fondatori centinaia di milioni di dollari, nonostante Moderna non abbia ancora messo sul mercato una propria soluzione. Rossi avrebbe poi abbandonato il progetto nel 2014, con qualche polemica.
Dalla Turchia a BioNTech
I progressi legati all’mRNA avevano intanto suscitato qualche attenzione anche in Europa, in particolare in Germania, dove una coppia di ricercatori aveva intuito le grandi potenzialità del sistema. È una storia di successo imprenditoriale, molto raccontata negli ultimi giorni dopo gli annunci dei primi risultati positivi del vaccino di Pfizer-BioNTech.
Entrambi di origini turche, Uğur Şahin e Özlem Türeci avevano dedicato buona parte dei loro studi e delle loro ricerche alle immunoterapie, cioè ai sistemi per sfruttare le capacità del nostro sistema immunitario per contrastare particolari malattie come i tumori. Pensarono che l’mRNA potesse diventare un valido alleato per creare una sorta di vaccino per insegnare al sistema immunitario a riconoscere e distruggere le cellule tumorali.

Uğur Şahin e Özlem Türeci (BioNTech)
Per sperimentare questa possibilità, nel 2008 fondarono BioNTech, azienda di biotecnologie nella quale fecero in seguito confluire parte dei fondi ottenuti attraverso la vendita di un’altra azienda che avevano creato e poi venduto per 1,4 miliardi di dollari alla multinazionale del farmaco giapponese Astellas. La sede principale dell’azienda è a Magonza, in Germania, con una altrettanto importante a Cambridge, nel Massachusetts (Stati Uniti).
Şahin e Türeci ottennero le licenze per utilizzare i primi brevetti sviluppati per l’impiego e la modifica dell’mRNA e proposero poi a Karikó di lavorare con loro, per sviluppare ed estendere i loro progetti. Nel 2013, a circa vent’anni dal periodo in cui riceveva molti “no, no, no”, Karikó divenne vicepresidente di BioNTech con l’incarico di supervisionare i progetti di ricerca intorno all’mRNA.
Profilo basso
Soprattutto per l’indole dei suoi fondatori interessati a non avere distrazioni, BioNTech mantenne per diversi anni un profilo piuttosto basso, concentrandosi sulla sperimentazione e la pubblicazione degli studi su alcune delle più importanti riviste scientifiche. Nel 2013 la società avviò collaborazioni con diverse grandi aziende farmaceutiche, mantenendo come primo obiettivo lo sviluppo di immunoterapie contro i tumori, con più di dieci soluzioni ora in fase di sperimentazione.
Nel 2019 BioNTech iniziò a differenziare un poco i propri orizzonti di ricerca, stringendo per esempio un accordo con la Bill & Melinda Gates Foundation per realizzare nuove soluzioni contro la tubercolosi e l’HIV. Inoltre, a ottobre dello scorso anno l’azienda si è quotata in borsa raggiungendo un valore di mercato di circa 3,4 miliardi di dollari, quasi la metà del valore di Moderna al momento della propria quotazione nel 2018. Oggi, anche grazie al vaccino sperimentale sul coronavirus, BioNTech ha un valore di mercato di circa 22 miliardi di dollari.
Fare rumore
Moderna nei suoi primi anni dalla fondazione adottò una strategia opposta a quella di BioNTech, cercando di essere il più rumorosa possibile per farsi notare. Ci riuscì molto bene, soprattutto grazie a Stéphane Bancel, che ne era diventato amministratore delegato nel 2011 – dopo una precedente esperienza in una società francese di diagnostica – e che tuttora guida l’azienda statunitense.
Bancel pensò che il modo migliore per far conoscere Moderna fosse pubblicizzarne le potenzialità e soprattutto la capacità di raccogliere facilmente finanziamenti, un approccio non molto diverso da quello adottato da numerose startup nella Silicon Valley. Nel 2012 annunciò quindi di avere ottenuto oltre 40 milioni di dollari da svariati fondi di investimento, anche se all’epoca le ricerche condotte dai suoi laboratori erano ancora a uno stadio primordiale e distanti da qualsiasi utilizzo sui pazienti.

Il CEO di Moderna, Stephane Bancel (AP Photo/Andrew Harnik)
Poco dopo, Moderna stupì diversi osservatori e analisti stringendo un accordo, sostanzialmente sulla fiducia, con la società farmaceutica britannica AstraZeneca. Ottenne un contratto da 240 milioni di dollari per fornire ad AstraZeneca l’utilizzo in licenza di farmaci basati sull’mRNA che ancora non aveva creato.
Sei anni dopo si sarebbe quotata in borsa avendo raccolto investimenti per oltre 2 miliardi di dollari, ma con un grattacapo irrisolto che rischiava di metterla in crisi.
Dosi alte e basse
I suoi ricercatori erano incappati nel problema che Karikó aveva sperimentato negli anni Novanta, e che era riuscita sì a superare, ma solo in determinate circostanze. Attraverso esperimenti di laboratorio sulle cavie, avevano notato che la dose necessaria per la loro terapia sperimentale a base di mRNA induceva comunque una risposta indesiderata e piuttosto rischiosa del sistema immunitario. L’impiego di una dose più bassa evitava questo problema, ma offriva risultati deludenti per terapie elaborate.
Serviva qualcosa di meno complicato e che prevedesse l’impiego di dosi più basse. I vaccini rientravano perfettamente in questa categoria: in generale, si basano sulla somministrazione di una dose relativamente bassa delle sostanze che stimoleranno la risposta immunitaria. I responsabili di Moderna misero in pausa i loro piani più ambiziosi, per iniziare a sperimentare gli effetti dei vaccini con mRNA. Sarebbe stato meno remunerativo, ma avrebbe permesso di avviare sperimentazioni sugli esseri umani in vista di futuri sviluppi per terapie più complesse.
L’opportunità dall’imprevisto
Alla fine del 2019, mentre erano alle prese con queste e altre difficoltà tipiche di chi dalla teoria sta cercando di passare alla pratica, Moderna e BioNTech si trovarono davanti la più grande e imprevista opportunità per mettere a frutto le proprie conoscenze in breve tempo.
Nella città cinese di Wuhan alla fine di dicembre era stata riscontrata una quantità superiore al normale di polmoniti, la cui causa sarebbe diventata chiara nei primi giorni del 2020: erano dovute a un nuovo coronavirus, mai osservato prima e con la potenzialità di causare una pandemia.
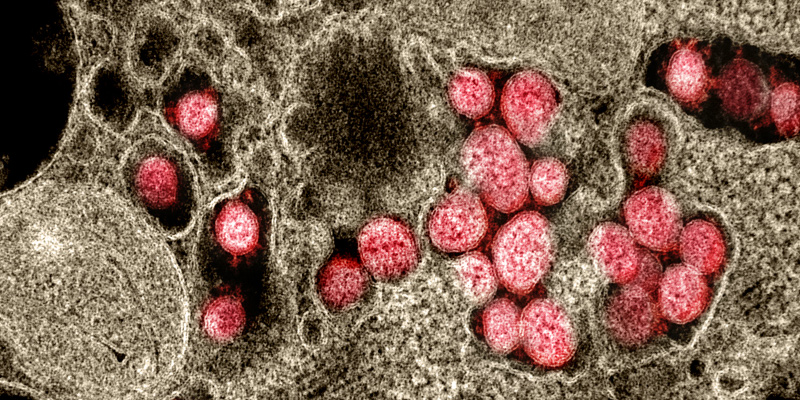
Coronavirus, in rosso, tra i tessuti cellulari, osservati al microscopio elettronico (NIAID)
La sequenza genetica del virus fu resa pubblica il 10 gennaio e numerose aziende di biotecnologie si misero al lavoro per capire se fosse percorribile la strada di un vaccino. Per Moderna e BioNTech era l’occasione per sperimentare i loro sistemi e migliorare le conoscenze in un settore ancora poco esplorato come quello dei vaccini a base di mRNA.
Il vantaggio di lavorare con il materiale genetico è che non occorre avere una copia del virus vero e proprio nei laboratori per elaborare un vaccino: è sufficiente conoscere il modo in cui è organizzato il suo RNA, e sulla base di questo modellare al computer la sequenza da inserire nelle cellule per far credere al sistema immunitario di essere in presenza del coronavirus vero e proprio, inducendolo a organizzarsi per renderlo innocuo.
In poco più di un mese, Moderna non solo fu in grado di elaborare una propria soluzione, ma produsse anche un primo lotto di dosi del vaccino sperimentale, poi analizzato dall’Istituto nazionale per le allergie e le malattie infettive degli Stati Uniti, che aveva collaborato all’identificazione della sequenza su cui intervenire. Poche settimane dopo avviò i test di laboratorio e in seguito la prima di tre fasi di test clinici su volontari, per verificare prima di tutto la sicurezza del proprio vaccino, e in un secondo momento la sua efficacia.
Sempre a gennaio, in Germania, i fondatori di BioNTech avviarono lo sviluppo di una propria versione del vaccino basata sull’mRNA e iniziarono a guardarsi intorno per trovare un partner, con le giuste capacità per produrre in breve tempo milioni di dosi. Proposero alla statunitense Pfizer di collaborare al progetto, visto che le due aziende avevano già lavorato insieme esplorando la possibilità di produrre vaccini antinfluenzali. Furono sufficienti poche telefonate per avviare il progetto, che a valle dell’ultimo test clinico su oltre 44mila volontari ha fatto riscontrare un’efficacia del 95 per cento.
La competizione tra le uniche due aziende ad essere arrivate alla fine della fase 3 con un vaccino contro il coronavirus a base di mRNA si è fatta più serrata nelle ultime settimane, con la pubblicazione di comunicati stampa dai toni a dir poco entusiastici, che hanno fatto sollevare qualche perplessità da parte di esperti e dalle altre aziende farmaceutiche al lavoro su vaccini più tradizionali e ancora in corso di sperimentazione.
Moderna in particolare ha lavorato molto sulle pubbliche relazioni e sugli annunci a effetto in questi mesi. Lo scorso maggio aveva già annunciato risultati preliminari definiti promettenti, nonostante fossero basati su appena 8 volontari, in una fase ancora poco avanzata dei test clinici e senza particolari informazioni scientifiche di contesto. La tendenza a fare annunci a effetto è stata mantenuta anche nel comunicare i risultati, sempre preliminari e con pochi dati, sulle altre fasi dei test clinici.
Gli annunci hanno giovato sicuramente al titolo in borsa dell’azienda e ai suo dirigenti proprietari di azioni. Alcuni di loro, compresi il CEO e il responsabile scientifico Tal Zaks, ne hanno vendute ricavando decine di milioni di dollari, approfittando del momento propizio in borsa dato dalle aspettative sul loro vaccino. Nulla di illecito, naturalmente, ma in molti hanno definito poco opportune operazioni di questo tipo, in fondo possibili per la presenza di una pandemia che ha causato oltre 1,3 milioni di morti rilevate e che continuerà a fare danni, anche economici.
Stando alle verifiche effettuate da STAT, i dirigenti di BioNTech non hanno finora venduto azioni, ma hanno comunque visto aumentare enormemente il valore dei loro pacchetti azionari. Şahin e Türeci sono tra le cento persone più ricche della Germania, secondo una classifica realizzata dal settimanale Welt am Sonntag.
Politica e finanziamenti
Le due aziende hanno seguito approcci diversi anche nei confronti delle ingerenze da parte della politica statunitense. Nel corso della campagna elettorale per le presidenziali, Donald Trump ha più volte fatto annunci sull’imminente arrivo di un vaccino, citando proprio il lavoro di Pfizer-BioNTech e di Moderna, facendo spesso verbalmente pressioni nei confronti di queste aziende per fare presto. Trump lo ha fatto criticando anche la Food and Drug Administration (FDA), l’agenzia federale che si occupa di farmaci, sostenendo – senza fornire prove – che non stesse facendo abbastanza per accelerare l’approvazione dei nuovi vaccini.
In molti hanno fatto notare come in queste circostanze Moderna abbia usufruito di un finanziamento vantaggioso da parte del governo degli Stati Uniti, per lo sviluppo e la produzione del vaccino sperimentale. Il governo si è inoltre impegnato ad acquistare almeno 100 milioni di dosi per 2,48 miliardi di dollari.
Pfizer, per quanto possibile, ha preferito distanziarsi dal governo e non ha partecipato a nessuna iniziativa di finanziamento pubblico. Se il vaccino sperimentato con BioNTech, costato centinaia di milioni di dollari per essere sviluppato e prodotto, dovesse rivelarsi un fallimento, Pfizer si farà interamente carico delle perdite. L’azienda in compenso potrebbe ottenere enormi ricavi se il vaccino funzionasse: negli Stati Uniti ha ricevuto prenotazioni per 1,95 miliardi di dollari per almeno 100 milioni di dosi, e l’Unione Europea ha da poco avviato i contatti per prenotare 300 milioni di vaccini.
Efficacia e logistica
I vaccini di Pfizer-BioNTech e di Moderna hanno fatto riscontrare livelli di efficacia simili, ma solamente il loro impiego su larga scala tra la popolazione potrà confermare la validità delle stime al di sopra del 90 per cento. Accade spesso che i vaccini si rivelino meno efficaci, una volta impiegati in condizioni reali e su quantità di persone molto più ampie rispetto a quelle delle sperimentazioni cliniche.
A oggi non è inoltre noto per quanto tempo i due vaccini offrano una protezione contro il coronavirus, un dettaglio non di poco conto e sul quale abbiamo pochi dati per via della grande accelerazione nel loro sviluppo, rispetto ai tempi solitamente richiesti per la sperimentazione di vaccini completamente nuovi. I risultati ottenuti con i test clinici sono promettenti, ma richiederanno comunque ulteriori analisi e valutazioni da parte degli organismi di controllo.
La gestione stessa delle campagne vaccinali comporterà un maggiore impegno da parte dei sistemi sanitari: per entrambi i vaccini è infatti necessaria la somministrazione di due dosi, ad alcune settimane di distanza l’una dall’altra.

Ghiaccio secco (Leon Neal/Getty Images)
Produrre e distribuire centinaia di milioni di dosi in poco tempo non sarà inoltre semplice dal punto di vista della logistica, soprattutto per il vaccino di Pfizer-BioNTech, perché deve essere conservato a una temperatura intorno ai -70 °C. Dovrà essere garantita la catena del freddo e per questo Pfizer ha annunciato di avere sviluppato contenitori con materiale isolante e ghiaccio secco, che dovrebbero garantire il mantenimento di una temperatura così bassa per diversi giorni.
In questo, Moderna potrebbe avere un vantaggio competitivo non indifferente: il suo vaccino deve essere tenuto sì a bassa temperatura, ma non così bassa come quello della concorrenza. Si conserva a -20 °C e una volta scongelato rimane stabile per una trentina di giorni, se conservato tra 2 e 8 °C. Queste temperature da frigorifero, e non da congelatori molto potenti, dovrebbero porre meno difficoltà nel trasporto e nella conservazione del vaccino nelle farmacie e negli ospedali, già attrezzati per mantenere vaccini di altro tipo nei frigoriferi.
Moderna e Pfizer-BioNTech non saranno comunque le uniche aziende a distribuire vaccini contro il coronavirus. Una decina di altre soluzioni, sviluppate con sistemi più tradizionali e rodati, è nella terza e ultima fase di sperimentazione clinica. Alcuni di questi vaccini, come quello di AstraZeneca, hanno dato risultati preliminari incoraggianti e potrebbero ricevere autorizzazioni da parte delle istituzioni sanitarie entro la fine dell’anno.
Una grande scommessa
Al di là degli aspetti commerciali, se Pfizer-BioNTech e Moderna dovessero ricevere le autorizzazioni per distribuire i loro vaccini, nei prossimi mesi assisteremmo al più grande esperimento mai condotto sull’mRNA creato in laboratorio.
Se la sicurezza e l’efficacia dei due vaccini saranno confermate nell’impiego su ampie fasce della popolazione, i preparati con mRNA avranno superato il loro test più importante, e si potrà aprire la strada per diversi vaccini e farmaci basati su questa soluzione. Sia Moderna sia BioNTech sono del resto già da tempo al lavoro per risolvere il problema di diverse malattie.
Moderna ha per esempio avviato test su diversi altri vaccini, compreso uno per prevenire le infezioni da citomegalovirus, un virus che fa parte della famiglia degli Herpesvirus e che può essere trasmesso in vari modi, anche dalla madre al figlio durante la gravidanza, il parto o l’allattamento. Le infezioni causate da questo virus passano spesso inosservate, ma negli individui immunodepressi fanno aumentare il rischio di sviluppare sintomi gravi. Il vaccino sperimentale si è rivelato sicuro e ha prodotto una risposta immunitaria, ma saranno necessari ulteriori approfondimenti.
Insieme all’azienda farmaceutica Merck, Moderna sta esplorando la possibilità di produrre vaccini terapeutici contro il cancro, un settore di primario interesse per la concorrente BioNTech. L’idea è di creare un vaccino mirato per ogni paziente, sulla base delle mutazioni genetiche riscontrate nelle cellule tumorali, e di somministrarlo insieme al Keytruda, un farmaco specifico per i tumori distribuito da Merck. Una prima sperimentazione su pazienti con cancro alla testa e al collo ha dato esiti positivi, ma è stata condotta su un numero molto ristretto di individui e si attendono quindi esperienze cliniche e dati più significativi.
BioNTech sta intanto proseguendo nello sviluppo di vaccini terapeutici contro diversi tipi di tumore, da quello al seno a quello della pelle. Ha inoltre in lavorazione una soluzione basata sull’mRNA contro il tumore al pancreas, che in alcune circostanze si rivela difficile da trattare e altamente letale. Tra i vaccini per i quali ha avviato le sperimentazioni cliniche, BioNTech ne ha uno per il tumore della pelle, che sembra essere promettente.
Dalle grandi crisi derivano spesso grandi opportunità. La pandemia da coronavirus potrebbe accelerare la ricerca e lo sviluppo di nuovi vaccini e farmaci all’avanguardia, che potrebbero avere un forte impatto sulla medicina e in definitiva sulla vita di tutti noi. A trent’anni di distanza dai primi studi di un’ostinata ricercatrice e dei suoi colleghi, potremmo essere a pochi mesi da scoprire l’esito di questa grande scommessa.