Il primo farmaco creato per un solo paziente
Il milasen è stato sviluppato unicamente per una bambina americana affetta da una malattia rarissima, cosa che ha aperto un dibattito
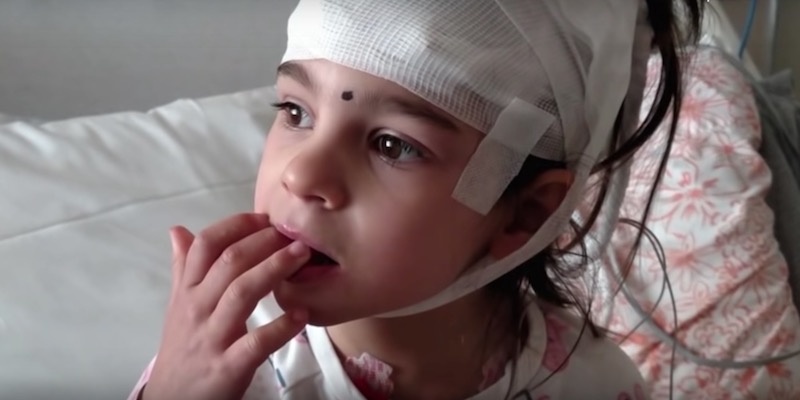
Negli ultimi giorni sui giornali di tutto il mondo è stata raccontata la storia di Mila Makovec, una bambina americana di 8 anni con una malattia neurodegenerativa rarissima, e del farmaco che sta assumendo, probabilmente il primo a essere stato sviluppato per essere preso da un’unica persona. La malattia da cui è affetta Makovec, il morbo di Batten, è infatti una malattia genetica molto rara per cui non esiste una cura. Il farmaco sviluppato per la bambina è adatto solo a lei perché agisce su una particolare mutazione che ha soltanto lei; non è in grado di guarirla, ma ha permesso alle sue condizioni di migliorare. Se ne discute perché si è potuto realizzarlo solo grazie ai fondi raccolti dalla fondazione messa in piedi dai genitori di Makovec per aiutare la figlia: la maggior parte delle persone con una malattia rara non ottiene simili possibilità.
Il morbo di Batten è una malattia che normalmente si manifesta nei bambini di 4-7 anni e causa attacchi epilettici, difficoltà e poi impossibilità di camminare e muoversi, cecità, impossibilità di parlare e poi deglutire. Solitamente i bambini che ne sono affetti non vivono molto oltre i 10 anni di età. È dovuta a una mutazione del gene MFSD8 e per sviluppare la malattia un bambino deve avere la mutazione su entrambe le copie del gene. O almeno, questo è quello che succede nella maggior parte dei casi: Mila Makovec però ha sviluppato il morbo pur avendo un’unica mutazione. Proprio per questa ragione è stato possibile sviluppare il “milasen”, il farmaco per aiutarla che prende il nome da quello della bambina.
Il milasen, descritto in un articolo pubblicato mercoledì sul New England Journal of Medicine, è stato messo a punto da Timothy Yu e da altri medici dell’Ospedale pediatrico di Boston. Nel 2017 Yu scoprì che Makovec aveva sviluppato il morbo di Batten perché un’altra mutazione del suo DNA impediva la produzione di una proteina. Gli venne quindi l’idea di sintetizzare un pezzo di RNA (cioè di quel tipo di molecole che fanno da “messaggero” per il trasferimento delle informazioni genetiche tra le cellule) che bloccasse gli effetti di quest’altra mutazione. Grazie ai fondi raccolti dalla Mila’s Miracle Foundation, la fondazione messa in piedi dalla madre di Makovec, Julia Vitarello, Yu e i suoi colleghi hanno potuto sviluppare il milasen, testarlo su alcune cavie animali e chiedere alla Food and Drug Administration (FDA), l’agenzia governativa statunitense che si occupa della sicurezza di cibi e farmaci, di farlo assumere alla bambina. Il permesso arrivò nel gennaio del 2018.
Esistono più di settemila malattie gravi rare e rarissime e solo negli Stati Uniti decine di migliaia di persone si trovano in situazioni simili a quelle di Makovec, ma non ci sono abbastanza ricercatori e, soprattutto, risorse finanziarie per cercare cure e terapie personalizzate per ognuno di loro. Gli stati non possono permettersi di fare ricerche così specifiche, nemmeno quei paesi in cui il sistema sanitario è pubblico, e le aziende farmaceutiche non hanno interesse economico a farlo dato che solo poche persone (o solo una) potrebbero beneficiarne.
L’unico modo per pagare la ricerca su questo genere di malattia sono i fondi accumulati dalle famiglie dei malati, ma non tutte le famiglie sono in grado di raccoglierli o hanno grandi patrimoni da cui partire. Vitarello ha raccolto 3 milioni di dollari con la fondazione messa in piedi per aiutare la figlia, ma né lei né Yu hanno voluto dire quanti soldi sono stati spesi per sviluppare il milasen.
Insieme all’articolo di Yu, il New England Journal of Medicine ha pubblicato un editoriale di Janet Woodcock, direttrice del Centro per la valutazione dei farmaci e delle ricerche della FDA, che si è chiesta quale priorità le istituzioni governative debbano dare a un farmaco che può curare solo un piccolissimo numero di persone. Ha poi sottolineato che anche la decisione di dare a Makovec il milasen dopo averlo testato solo su animali è legata a questioni etiche:
Quali tipi di risultati servono prima di far assumere un nuovo farmaco a una persona? Anche nel caso di malattie fatali che progrediscono velocemente non è accettabile far peggiorare le condizioni di un paziente, quindi come si può avere una minima garanzia sulla sicurezza indispensabile?
Non si sa bene quali potrebbero essere gli effetti collaterali del milasen e per questo Yu ha detto che farmaci del genere devono essere sviluppati e assunti solo nei casi di pazienti gravissimi, per cui non esistono altre cure. Un portavoce dell’FDA ha detto che l’agenzia spera di mettere insieme delle linee guida per gestire le richieste di approvazioni di farmaci come il milasen nel giro di un anno.
Il morbo di Batten fu diagnosticato a Mila Makovec nel 2016, quando la bambina aveva quattro anni. I suoi sintomi erano cominciati a 3: in precedenza era una bambina molto vivace, ma nel giro di poco tempo perse la vista e poi anche la capacità di tenere dritta la testa da sola. Prima di cominciare la terapia con il milasen, alla fine del 2018, veniva nutrita con un tubo e subiva fino a 30 attacchi epilettici al giorno, ciascuno della durata di uno o due minuti.
A un mese dalla prima assunzione del milasen – che Makovec riceve attraverso punture lombari, affinché il farmaco raggiunga il suo cervello – la bambina cominciò ad avere meno convulsioni e attacchi più brevi. Oggi ci sono giorni in cui non ne ha affatto, e quando ne ha (al massimo 6 al giorno) durano meno di un minuto. La bambina riesce di nuovo a deglutire cibi semiliquidi la maggior parte del tempo e a tenere la schiena e il collo dritti, quando viene sorretta. Tuttavia ha perso la capacità di parlare e continuerà ad avere grosse disabilità.