Frances H. Arnold, George P. Smith e Gregory P. Winter hanno vinto il premio Nobel per la Chimica
Per le loro ricerche su come controllare l'evoluzione e il sistema immunitario a nostro vantaggio

Il premio Nobel per la Chimica 2018 è stato assegnato a Frances H. Arnold, George P. Smith e Gregory P. Winter per i loro studi sullo sfruttamento di enzimi e anticorpi per produrre nuovi materiali, farmaci e terapie. L’annuncio è stato effettuato oggi poco prima delle 12 dal palazzo dell’Accademia Reale delle Scienze della Svezia, a Stoccolma.
Con le loro ricerche, i tre premiati di quest’anno hanno sfruttato i principi dell’evoluzione e della genetica riuscendo a produrre soluzioni che ci hanno migliorato la vita, dai biocarburanti a farmaci di nuova generazione contro malattie autoimmuni e tumori.
Frances H. Arnold e l’evoluzione diretta
L’esistenza e la prosecuzione della vita sul nostro pianeta sono stati resi possibili dall’evoluzione, che grazie a una buona percentuale di casualità ha man mano risolto molti problemi chimici. Tutti gli organismi viventi sono in grado di produrre energia da ciò che hanno intorno nel loro ambiente, creando a loro volta altri composti chimici utili alla loro esistenza.
La chimica della vita è descritta e programmata nei nostri geni, e viene quindi trasmessa di generazione in generazione. Mutazioni casuali durante la trasmissione fanno sì che cambino alcune cose: quasi sempre il risultato sono organismi più deboli e svantaggiati, altre volte si verificano miglioramenti che portano alcuni esemplari di una generazione a prevalere.
Arnold, Smith e Winter hanno cambiato la biochimica applicando gli stessi principi dell’evoluzione, ma in laboratorio.
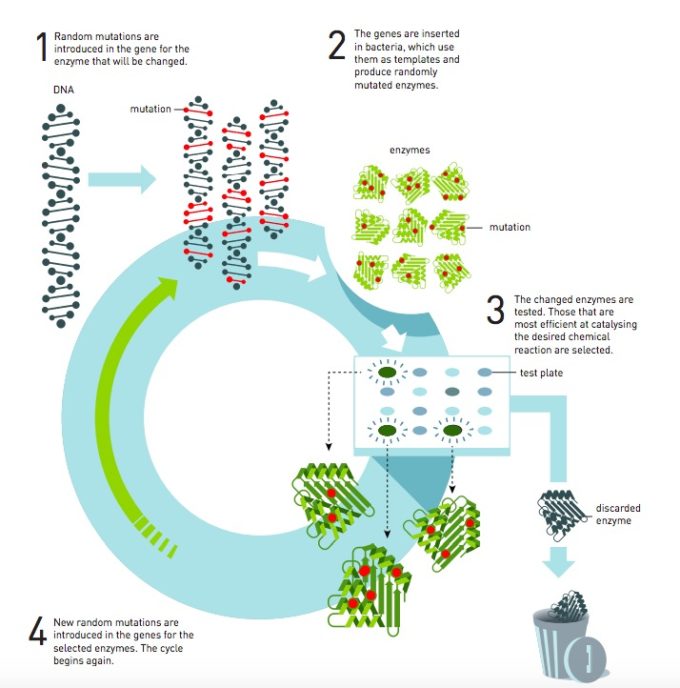
Frances Arnold ha 62 anni, è statunitense e iniziò a lavorare con le tecnologie del DNA negli anni Ottanta. La sua idea era semplice, ma al tempo stesso rivoluzionaria e difficile da realizzare: invece di produrre farmaci, oggetti e altri prodotti chimici attraverso la chimica tradizionale – con l’uso di solventi, metalli pesanti, acidi e altri inquinanti – sfruttiamo gli strumenti che impiega già la natura nel suo grande laboratorio chimico, gli enzimi. Ideandone di nuovi, imitando quelli esistenti, sarebbe stato possibile farlo, ipotizzò Arnold.
Dopo anni di prove fallimentari in laboratorio, dove cercava di combinare insieme le basi degli enzimi (gli amminoacidi) per crearne di nuovi, Arnold arrivò alla conclusione che fosse necessario seguire una strada diversa.
Riprese i lavori svolti fino ad allora con la subtlisina, un enzima che catalizza (cioè che favorisce e accelera) le reazioni chimiche in soluzioni a base di acqua, per fare in modo che facesse altrettanto in un solvente organico come la dimetilformammide (DMF). Realizzò alcune mutazioni (modifiche casuali) nel codice genetico dell’enzima e le inserì poi nei batteri, in modo che producessero migliaia di varianti della subtlisina. Ora si trattava di capire quali di queste varianti fossero più adatte per funzionare nella DMF.
Sapendo che la subtlisina scompone la caseina (la proteina del latte) selezionò le varianti dell’enzima che svolgeva meglio questo compito in una soluzione di latte e DMF. Gli enzimi selezionati furono la base per produrne di nuovi con ulteriori variazioni, che si rivelarono ancora più efficaci nella DMF. Fece altrettanto con una terza generazione, dirigendo di fatto l’evoluzione dell’enzima verso uno specifico compito, da qui “evoluzione diretta”.
Altri ricercatori dopo Arnold hanno lavorato a questo sistema, ottenendo risultati molto importanti per rendere più controllabile l’evoluzione diretta, in modo da ottenere risultati ancora più soddisfacenti con il processo di selezione. Frances Arnold è stata una pioniera di questa tecnica, che oggi permette di realizzare enzimi su misura e che non esistono in natura, utili per produrre farmaci e nuovi materiali.
La chimica del sistema immunitario
George Smith ha 77 anni, è statunitense e nella prima metà degli anni Ottanta iniziò a lavorare con i batteriofagi – i virus che infettano i batteri – nella speranza di poterli sfruttare per clonare i geni. All’epoca, tecniche del DNA di questo tipo erano ai loro primordi: i ricercatori sapevano dell’esistenza dei geni e dei loro ruoli nel dare le istruzioni per produrre le proteine, ma associare uno specifico gene a una proteina era estremamente difficile. Quando qualcuno ci riusciva era una grande notizia: il gene poteva essere inserito in un batterio per fare in modo che producesse la proteina oggetto di studio, con un po’ di fortuna. Smith pensava che questo sistema, noto come “clonaggio”, potesse essere migliorato sfruttando i batteriofagi.
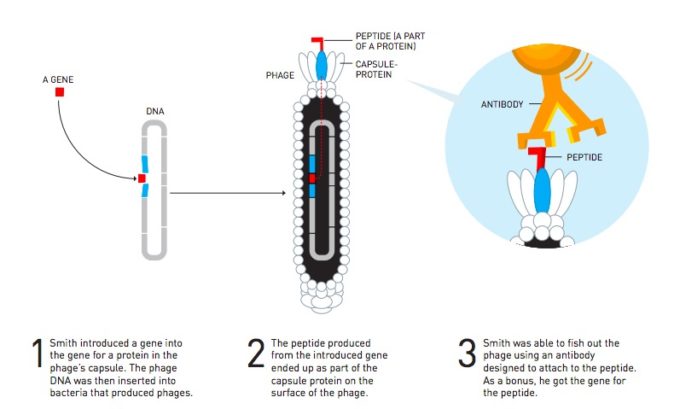
Un virus che attacca i batteri ha una struttura piuttosto semplice: possiede materiale genetico protetto da una capsula composta da alcune proteine. Quando si riproduce, non fa altro che iniettare il suo materiale genetico nel batterio, in modo da prendere il controllo del suo metabolismo. Il batterio diventa una fotocopiatrice del materiale genetico, portando alla produzione di repliche del virus, che così ha modo di diffondersi.
Smith pensò che questo sistema potesse essere sfruttato per una nuova tecnica di ricerca: partire da una proteina nota per andare a ritroso fino al gene che la codifica. All’epoca c’erano sterminati cataloghi di frammenti di geni sconosciuti e Smith riteneva che questi frammenti potessero essere uniti a uno dei geni che codifica le proteine della capsula del batteriofago. In questo modo, quando si fossero prodotti nuovi batteriofagi, le proteine codificate dai frammenti sarebbero diventate parte della capsula protettiva del batteriofago stesso, rivelando ai ricercatori la loro origine.
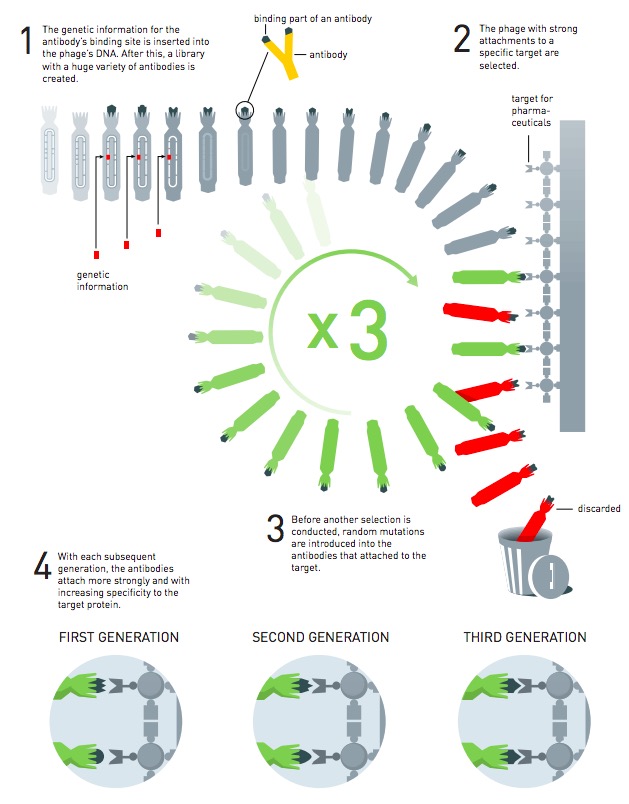
Il problema era che in questo modo si sarebbero prodotti batteriofagi con molte proteine diverse tra loro, perché si usavano più frammenti di geni per volta. Smith ipotizzò che per risolvere il sovraffollamento si potessero usare anticorpi specializzati per alcuni tipi di proteine. Sarebbe stato sufficiente usare un anticorpo per isolare una proteina e risalire quindi alle sue origini. Nel 1985 Smith tradusse dalla teoria alla pratica il suo sistema: era nata la tecnica del “phage display”, che sfrutta un batteriofago come spia per trovare un legame tra una proteina e il gene che la codifica.
Negli anni seguenti fu Winter – che ha 67 anni ed è del Regno Unito – a perfezionare il sistema immaginato e messo in pratica da Smith. Una delle chiavi del suo funzionamento sono gli anticorpi, i guardiani del nostro organismo e di quello di molti altri esseri viventi. Sono altamente specializzati, si attaccano a un agente esterno come un batterio o un virus e segnalano poi alle cellule del sistema immunitario di intervenire, per distruggere gli ospiti indesiderati. Questa alta specializzazione aveva le potenzialità per essere sfruttata dai ricercatori a loro vantaggio, per contrastare alcune malattie, ma gli esperimenti in laboratorio non stavano portando a grandi risultati. Winter allora iniziò a valutare il sistema di Smith per produrre direttamente farmaci basati sugli anticorpi umani, che sarebbero stati tollerati meglio dall’organismo.
Le ricerche portarono Winter a produrre nei primi anni Novanta l’adalimumab, uno dei primi farmaci biologici mai realizzati. Ha la capacità di neutralizzare la TNF-alpha, una proteina che causa forti infiammazioni nelle persone con particolari malattie autoimmuni. Il farmaco fu approvato per il suo utilizzo commerciale nel 2002 e da allora è impiegato in numerosi ambiti, soprattutto per il trattamento dell’artrite reumatoide. I successi dell’adalimumab hanno aperto la strada a innumerevoli altre sperimentazioni, con farmaci che sfruttano il sistema immunitario per neutralizzare le cellule tumorali, contrastare gravi malattie autoimmuni e neurologiche.
Grazie alle loro intuizioni, alla perseveranza nei loro studi e alle ricerche con i loro colleghi, i tre premiati con il Nobel per la Chimica di quest’anno sono stati tra i principali protagonisti del cambiamento della chimica, con benefici per tutti noi, non solo per il presente, ma anche per un futuro ormai non molto lontano.