Il gene di una malattia mortale è stato rimosso da embrioni umani per la prima volta
Usando una recente tecnica chiamata CRISPR-Cas9 che in futuro potrebbe evitare la trasmissione di circa 10mila malattie genetiche
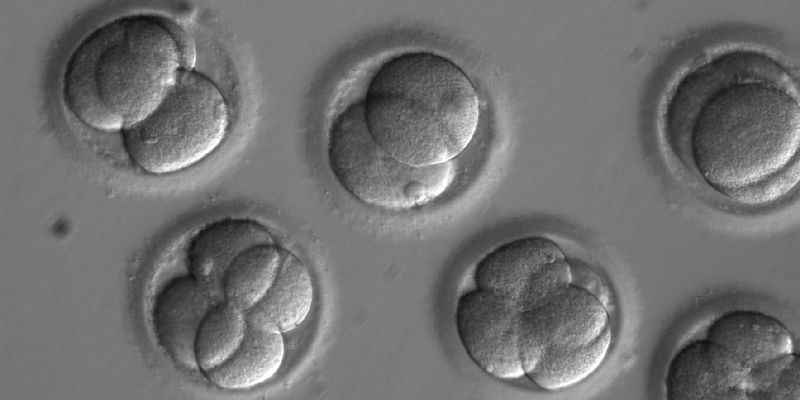
Per la prima volta un gruppo di scienziati ha modificato geneticamente degli embrioni umani in modo da eliminare un gene responsabile di una malattia cardiaca mortale, la cardiomiopatia ipertrofica. Lo hanno fatto utilizzando la tecnica CRISPR-Cas9 (chiamata anche semplicemente CRISPR), che in pratica permette di “copincollare” segmenti di DNA di un organismo in un altro. Questo risultato è stato raggiunto da una squadra di ricercatori americani, dell’Oregon Health and Science University e del Salk Institute, e sudcoreani, dell’Istituto per la Scienza di Base. L’articolo che spiega gli esperimenti e i loro risultati è stato pubblicato mercoledì sulla rivista Nature.
Il successo nella modifica di geni umani grazie alla CRISPR è una notizia importante perché esistono più di 10mila malattie genetiche che – come la cardiomiopatia ipertrofica – vengono trasmesse da un unico gene mutato (per esempio un tipo di tumore al seno, la malattia di Huntington o la fibrosi cistica) e forse in futuro, anche se non a breve, se ne potrebbe impedire la trasmissione alle nuove generazioni grazie all’ingegneria genetica. Ovviamente tutta la questione pone anche delle questioni etiche, dato che in linea teorica la possibilità di modificare geneticamente gli esseri umani prima che nascano potrebbe applicarsi a geni non legati a malattie ma ad altre caratteristiche fisiche.
La cardiomiopatia ipertrofica, la malattia sul cui gene i ricercatori hanno lavorato, è molto comune: affligge una persona ogni cinquecento e può causare un’improvvisa interruzione del battito del cuore. È dovuta alla mutazione di un unico gene (chiamato MYBPC3) e chiunque ce l’abbia ha il 50 per cento di probabilità di trasmetterla ai propri figli. La “correzione” nel codice genetico degli embrioni usati per lo studio è stata fatta con due tecniche diverse: nel primo caso gli spermatozoi di un uomo affetto da cardiomiopatia ipertrofica sono stati iniettati in ovuli donati da dodici donne sane e solo dopo il concepimento è stato aggiunto il CRISPR-Cas9, che funziona come una specie di piccola forbice del DNA; nel secondo caso gli spermatozoi e il CRISPR-Cas9 sono stati iniettati insieme. In una buona percentuale dei casi il CRISPR-Cas9 ha fatto sì che il gene mutato fosse eliminato dal DNA dell’embrione e che al suo posto venisse copiato il corrispondente gene del DNA dell’ovulo sano. Questo risultato è stato inaspettato per gli scienziati, che invece pensavano che nel DNA dell’embrione sarebbe stato inserito un gene sintetico introdotto con il CRISPR-Cas9.
A mutation causing a heritable heart condition has been corrected in preimplantation human embryos using CRISPR–Cas9 https://t.co/cbE6rYVUwT pic.twitter.com/ASQFd6dViI
— Nature Portfolio (@NaturePortfolio) August 2, 2017
Nel primo caso, 36 embrioni su 54 (cioè il 66,7 per cento) si sono sviluppati senza la mutazione responsabile della cardiomiopatia ipertrofica: un miglioramento rispetto a quanto avviene naturalmente, visto che la mutazione è trasmessa nel 50 per cento dei casi. Altri tredici embrioni di questi 54 si sono sviluppati avendo la mutazione ma non in tutte le cellule, una condizione che viene chiamata “mosaico” dai ricercatori. Nel secondo caso, cioè iniettando CRISPR-Cas9 insieme agli spermatozoi, 42 embrioni su 58 – cioè il 72 per cento – si sono sviluppati senza la mutazione; i restanti 16 invece avevano invece mostrato modifiche non volute del DNA. Tutti gli embrioni sviluppati per l’esperimento sono stati distrutti dopo circa tre giorni dal concepimento. Se fossero stati usati per generare dei bambini, non solo avrebbero portato a bambini sani ma anche a bambini che non avrebbero trasmesso la malattia a loro volta.
Shoukhrat Mitalipov, uno degli scienziati che ha lavorato allo studio, pensa che la tecnica si possa migliorare, che si possa arrivare al 90 per cento di embrioni senza la mutazione e che lo stesso processo possa essere usato nel caso in cui sia il DNA degli ovuli e non quello degli spermatozoi a contenere il gene della malattia. La tecnica non potrebbe essere usata invece nel caso in cui entrambi i genitori fossero portatori del gene mutato.
Richard Hynes, che si occupa di ricerca sui tumori al Massachusetts Institute of Technology e ha co-diretto la stesura di un codice di linee guida per la modifica degli embrioni commissionato dalla National Academy of Sciences e dalla National Academy of Medicine degli Stati Uniti, ha commentato in modo positivo i risultati di questo studio. Hynes ha detto al New York Times: «In passato abbiamo sempre detto che non si dovrebbero modificare geneticamente gli embrioni perché sapevamo che non poteva essere fatto in modo sicuro. Ora però sembra che presto potrà essere fatto in modo sicuro». Questo studio è il primo caso in cui la modifica genetica di embrioni umani ha davvero successo: dal 2015 sono stati fatti tre esperimenti simili in Cina, ma in pochissimi casi i ricercatori erano riusciti a ottenere le modifiche sperate.
R. Alta Charo, una bioeticista dell’Università del Wisconsin, che ha lavorato insieme a Hynes alle linee guida sulla modifica genetica degli embrioni umani, ha detto che il risultato ottenuto da questo esperimento potrebbe farci capire qualcosa in più anche su alcune cause dell’infertilità e degli aborti spontanei. Charo ha anche espresso dei dubbi sul fatto che molte coppie vorrebbero far modificare i propri figli con l’ingegneria genetica: secondo lei solo persone con motivi molto seri lo vorrebbero, visto che per far diventare embrioni geneticamente modificati dei bambini è indispensabile passare per la procreazione assistita e «il sesso è meno costoso e più divertente».



